8月5日,中国科学院生物物理研究所朱平研究组和李国红研究组,在《细胞研究》(Cell Research)上在线发表了题为Structural basis for linker histone H5–nucleosome binding and chromatin fiber compaction的研究论文。该研究获得了由连接组蛋白H5折叠十二个核小体形成的染色质颗粒3.6埃分辨率的冷冻电子显微镜结构,首次报道了由全长连接组蛋白H5(包括其N端结构域和C端结构域)及其与核小体核心颗粒形成的完整染色质小体结构,建立了由连接组蛋白H5介导形成的30nm染色质纤维的全原子结构模型。
在真核生物中,基因组DNA被分层包装到细胞核内不同层次的染色质组织中。其中,DNA缠绕在核心组蛋白组成的八聚体上组成核小体;多个核小体组成的串珠状结构,在连接组蛋白等的帮助下折叠形成直径在30nm左右的染色质纤维,并进一步折叠形成更紧密的染色质高维结构。在这一过程中,30nm染色质纤维承上启下,连接核小体串珠和高维染色质结构。它的折叠规律和调控机制是探讨染色质结构的关键,对于阐明染色质在调节基因表达以及其他DNA依赖性活动中的生物学作用具有重要意义。
该研究解析了由12×177bp_601DNA、核心组蛋白和连接组蛋白H5组装形成的H5结合十二核小体的染色质(以下简称H5-染色质纤维)的分辨率为3.6埃的冷冻电镜结构。
研究发现,与H1.4-30nm染色质纤维类似,H5-30nm染色质纤维以4个核小体为一个结构单元,各单元之间通过相互扭曲折叠Zig-Zag形成一个和DNA右手双螺旋类似的左手双螺旋高级结构。与研究组前期报道的H1.4-30nm染色质结构解析分辨率相比,该研究获得的H5-30nm染色质结构解析分辨率有了较大提升。同时,研究关注的染色质高级结构形成过程中的关键相互作用,如四核小体结构单元内部及单元之间的核心组蛋白-核心组蛋白、核心组蛋白-连接组蛋白以及连接组蛋白-linker DNA之间的相互作用细节得以呈现。科研人员基于研究获得的高分辨率冷冻电子显微密度图,建立了完整的H5-30nm染色质纤维全原子结构模型。
连接组蛋白在染色质压缩以及高级结构形成中具有关键作用。不同的连接组蛋白包括一个N端结构域(NTD)、一个球形结构域(GD)以及一个C端结构域(CTD)。由于富含带电氨基酸,连接组蛋白的NTD和CTD在溶液状态下呈现高度无序的状态。迄今为止,只有占全长连接组蛋白的1/3左右的GD结构域的结构得到解析。该研究获得了连接组蛋白H5的全长蛋白,包括其N端结构域NTD和C端结构域CTD的原子分辨率结构,建立了完整染色质小体的原子分辨率结构。研究显示,在H5-30nm染色质纤维中,连接组蛋白H5以非对称三点接触方式结合在核小体核心颗粒上。其中,H5的CTD结构域形成经典的HMG-like螺旋折叠方式以紧密结合在linker DNA上,并通过H5的NTD和CTD结构域与连接DNA的相互作用促进染色质高级结构的折叠和高级结构形成。
研究发现,染色质纤维高级结构形成过程中具有多重结构不对称性。同时,研究利用遗传学、基因组学和生物物理方法系统验证了真核生物芽殖酵母中四核小体折叠单元的生理功能和结构特征。基于上述成果,研究人员提出了连接组蛋白H5介导的核小体结合与染色质折叠和高级结构形成的分子机制模型。
该工作对于染色质纤维高分辨率结构精细模型的建立以及染色质的高级结构组装和表观遗传调控机制的研究具有重要意义,为探讨体内染色质结构建立的分子基础以及各种表观遗传因素对染色质结构调控的可能机理提供了结构基础。
研究工作得到科学技术部、国家自然科学基金委员会、中国科学院等的支持。
论文链接

H5-30nm染色质纤维冷冻电镜结构(a)及原子结构模型(b)
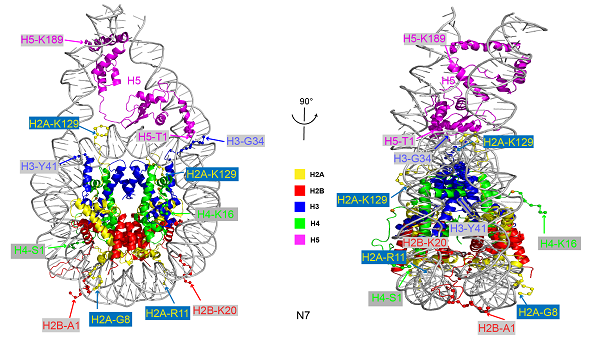
全长连接组蛋白H5与核小体核心颗粒形成的完整染色质小体结构
供稿人:杨越
审核人:文成锋




