9月19日,中国科学院上海药物研究所研究员甘勇、副研究员俞淼荣,联合浙江大学教授胡国庆,在《自然-纳米技术》(Nature Nanotechnology)上在线发表了题为Direct Cytosolic Delivery of siRNA via Cell Membrane Fusion Using Cholesterol-Enriched Exosomes的研究论文。科研人员结合理论建模和实验研究揭示了胆固醇在调控外泌体递释RNA药物中的作用与机制,开发了高效的工程化外泌体RNA递释系统,为基因治疗提供了安全高效的创新递释策略。
近年来,RNA干扰(RNAi)技术在基因表达调控领域具有潜力,逐渐成为治疗遗传性疾病和癌症等疾病的前沿技术。然而,RNA的递释效率和安全性是临床应用的难题。虽然已有RNA递释系统在临床中使用,但它们在细胞内溶酶体的逃逸效率较低,限制了其疗效。
外泌体作为天然的纳米级细胞外囊泡,因出色的生物相容性、稳定性、长效的体内循环时间以及精准的组织靶向能力,逐渐成为优化RNA递释的研究热点。然而,天然外泌体进入细胞主要依赖内吞作用,导致RNA分子易在溶酶体中被迅速降解,限制了其递释效率。
该团队采用外泌体工程化可控修饰策略,定量化调控了不同种类外泌体中胆固醇的含量如牛奶外泌体、生姜外泌体、肿瘤细胞来源的外泌体等,并利用透射电子显微镜等技术对其进行了全面表征。研究表明,外泌体膜中胆固醇含量的增加增强了其与靶细胞膜的相互作用,促使外泌体通过膜融合而非内吞途径进入细胞,降低了溶酶体降解的限制。同时,分子模拟研究显示,富含胆固醇的外泌体具有更强的膜变形能力,能够扩大其与细胞膜的接触面积,从而通过膜融合机制将小干扰RNA(siRNA)直接高效递送至细胞质内。
体外实验中,富含30%胆固醇的牛奶外泌体(30% Chol/MEs)递送了PLK1 siRNA,下调了PLK1 mRNA和蛋白表达水平,诱导了肿瘤细胞凋亡,且其效果优于传统的转染试剂Lipo 2000和RNAiMAX。进一步,体内实验证实,30% Chol/MEs/siPLK1通过口服或静脉注射方式,在小鼠结直肠肿瘤模型中均能够有效抑制肿瘤生长,展现了其作为基因治疗载体的潜力。
研究工作得到国家杰出青年科学基金和国家重点研发计划等的资助,并获得中国科学院上海高等研究院国家蛋白质科学研究(上海)设施的技术支持。
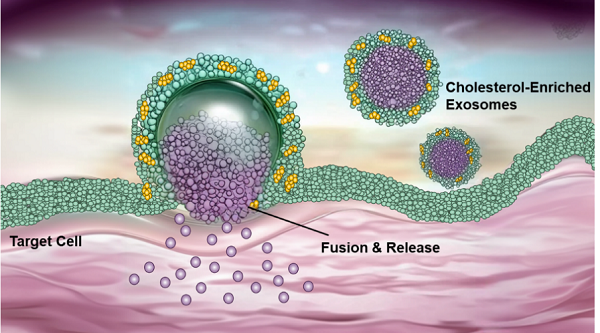
富含胆固醇的外泌体递释RNA药物示意图
供稿人:杨越
审核人:文成锋




