mRNA疗法因研发周期短、生产成本低、制备工艺简单、起效快等优势,被广泛应用于疫苗研发、蛋白替代疗法和基因编辑等领域。脂质纳米颗粒(LNP)是目前递送mRNA的最佳载体之一,但LNP的靶向递送能力存在限制。LNP在肝脏和肌肉递送方面已取得进展,但对肝外器官的靶向递送面临挑战。此前,科学家开发了通用的器官选择性递送策略(SORT技术)。SORT技术通过在传统的四组分LNP中引入带有不同电荷的SORT脂质分子,可将mRNA特异性地递送至小鼠的肝脏、脾脏或肺部。然而,SORT技术局限于器官层面的靶向,无法实现对靶器官内特定细胞类型的选择性递送。
10月10日,中国科学院动物研究所魏妥研究组与北京大学程强课题组合作,在《先进材料》(Advanced Materials)上发表了题为Simplified Lipid Nanoparticles for Tissue- And Cell-Targeted mRNA Delivery Facilitate Precision Tumor Therapy in a Lung Metastasis Mouse Model的研究论文。该研究结合基于LNP的器官靶向递送和mRNA序列的受控表达,开发了器官和细胞双重特异性的mRNA-LNP递送平台(SELECT平台)。这一平台通过系统优化开发出三组分LNPs,可将mRNA靶向递送到肺脏、肝脏和脾脏;在mRNA骨架中引入特定的microRNA(miRNA)靶点的反向互补序列,实现了mRNA在靶组织特定细胞类型中的受控蛋白质表达。
该研究借助SORT技术获得靶向肺部的五组分SM-102 LNP,进而通过正交实验优化LNP组分。结果发现,与五组分LNP和四组分LNP相比,去除磷脂DSPC和胆固醇的三组分LNP(stLNP)在递送效率和器官特异性方面表现更佳。stLNP不仅为靶向递送至肺脏、脾脏和肝脏提供了通用策略,而且简化了LNP的优化过程。同时,研究人员在mRNA骨架中引入miR-142的反向互补序列(miR-142ts),解决了肺靶向stLNP和肝靶向stLNP在脾脏器官中的表达泄漏问题,并提高了stLNP在肺脏和肝脏中的递送效率。
进一步,该研究分析肿瘤细胞与肺部正常组织细胞中miRNA的表达丰度差异发现,miR-126在肺部正常组织细胞中表达高而在肿瘤细胞中表达低。借助细胞内源性miRNA的表达差异,科研人员将miR-142ts和miR-126ts双靶点整合到mRNA骨架中,降低了mRNA在肺部正常组织细胞中的表达且不影响其在肿瘤细胞中的高表达,提出了将mRNA精确递送到肺内肿瘤细胞的方法,并将这一方法命名为SELECT。为了验证SELECT技术能否实现精准肿瘤治疗,该团队筛选并合成了来源于人中性粒细胞的弹性蛋白酶(hELANE)mRNA。这一靶点可以特异性杀伤肿瘤细胞,且对正常细胞造成的损伤最小。在黑色素瘤肺转移模型中,miR142ts-126tsSELECT-hELANE实现了针对肿瘤细胞的mRNA药物精准递送,并产生了高效的抑瘤效果。
该研究开发了简化LNP平台与工程化mRNA结合的精准肿瘤治疗策略,提高了mRNA疗法在肺转移肿瘤中的治疗效果。这一策略具有临床应用潜力,为实现精准肿瘤治疗提供了新的技术方向,并在其他特定细胞类型的mRNA疗法方面展现了潜在应用前景。
研究工作得到国家重点研发计划和国家自然科学基金等的支持。
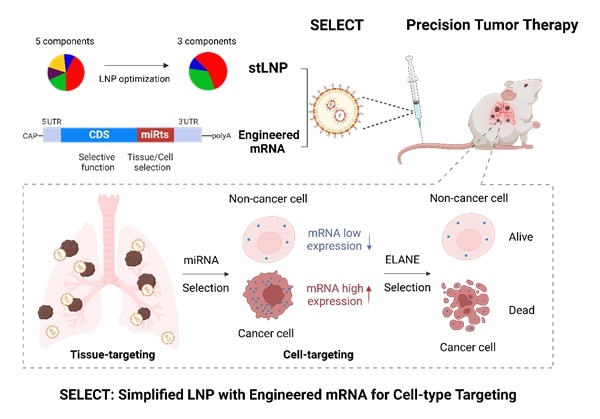
SELECT技术介导器官和细胞双重特异性mRNA递送
供稿人:杨越
审核人:文成锋




