近日,中国科学院院士、国家纳米科学中心研究员陈春英团队在基于纳米颗粒的无线深度脑刺激系统治疗帕金森病方面取得进展。相关研究成果以A Nanoparticle-Based Wireless Deep Brain Stimulation System that Reverses Parkinson’s Disease为题,发表在《科学进展》(Science Advances)上。
帕金森病是神经退行性疾病,以运动障碍为主要特征。帕金森病病理表现为α-突触核蛋白(α-syn)异常聚集形成不溶性纤维及路易小体,导致中脑黑质多巴胺能神经元退化和死亡,影响神经元通过黑质-纹状体通路将多巴胺投射到纹状体。目前,为了改善患者的运动功能,临床采用将电极植入大脑特定位置的方式,通过直接电刺激来调整神经元活动。这种深部脑刺激方法提高了调控神经元的效率,但其侵入性的特点易引发认知功能下降和情绪波动。后续开发的非侵入式技术能够增强皮层兴奋性,但因穿透深度和空间分辨率不足,难以精准调控深部脑区。因此,发展兼具高空间分辨率和强穿透能力的非侵入性深部脑刺激技术至关重要。
该团队设计了光热无线深部脑刺激纳米系统,并命名为ATB NPs。ATB NPs通过直接刺激神经元内源性表达的热敏TRPV1受体,实现对退化神经元的精准调控。ATB NPs由三个核心模块组成:光热转换模块(金纳米壳AuNSs),用于激活热敏TRPV1离子通道;靶向模块(TRPV1抗体),靶向高表达TRPV1受体的多巴胺能神经元;降解模块(β-syn多肽,含近红外响应连接体),通过结合α-syn的非淀粉样蛋白-β成分疏水结构域,降解α-syn纤维。研究显示,通过立体定位技术将ATB NPs注射至帕金森病小鼠的黑质后,ATB NPs借助TRPV1抗体锚定在多巴胺能神经元表面。在808 nm脉冲近红外激光照射下,ATB NPs作为纳米天线进行光热转换,激活热敏TRPV1受体,引起Ca2+内流和动作电位产生。同时,ATB NPs释放β-syn多肽,并通过激活分子伴侣介导的自噬途径,清除α-syn聚集体,减少病理性纤维。研究发现,ATB NPs能够恢复多巴胺能神经元的交互网络及多巴胺释放能力,改善帕金森病小鼠的运动功能。
ATB NPs利用黑质多巴胺能神经元内源性表达的TRPV1受体,无需植入神经电极或进行基因操作;结合近红外激光技术,能够对特定脑区的退行性神经元实现精准的时空调控;具有良好的生物安全性。这一策略为帕金森病及其他神经退行性疾病的治疗提供了新思路。
研究工作得到国家重点研发计划、国家自然科学基金、中国科学院相关项目等的支持。
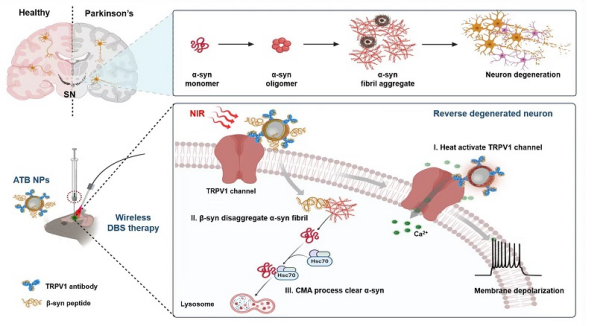
无线深部脑刺激纳米系统治疗帕金森病示意图
供稿人:杨越
审核人:文成锋




