鼻咽癌是源于鼻咽黏膜的恶性肿瘤。由于鼻咽解剖位置的特殊性,放疗是鼻咽癌的主要治疗手段。尽管放疗技术的进步提高了早期患者的生存率,但晚期患者的治疗效果仍然受限,并常因局部复发和远程转移导致治疗失败。其中,肿瘤微环境高度乏氧是放疗失败的重要原因之一。同时,传统方法如高压氧疗法和携氧剂存在局限性。因此,开发高效且精准的放疗增敏策略是鼻咽癌等实体瘤临床治疗的迫切需求。
在这一背景下,具有类过氧化氢酶活性的纳米酶因独特的优势而备受关注。纳米酶能够在肿瘤微环境中催化过氧化氢分解,原位持续生成氧气,从而改善肿瘤乏氧状态。相比传统方法,纳米酶避免了氧气消耗迅速、难以控制或毒性显著等问题,更符合临床实际需求。要实现纳米酶的高效应用,关键在于精准靶向乏氧病灶。目前,关于乏氧肿瘤细胞表面标志物的研究有限,在一定程度上阻碍了靶向策略的开发工作。
中国科学院院士、生物物理研究所研究员阎锡蕴与研究员范克龙团队,联合中山大学附属第五医院教授王颖团队、广西医科大学教授张哲团队,针对鼻咽癌的细胞表面靶点进行广泛筛选,鉴定出转铁蛋白受体1(TfR1)作为乏氧病灶的特异性靶点,并开发了针对性的纳米酶递送系统和放疗增敏策略。这一策略显著改善了鼻咽癌的乏氧状况并提升了放疗效果。1月21日,相关研究成果以Hypoxia-tropic delivery of nanozymes targeting transferrin receptor 1 for nasopharyngeal carcinoma radiotherapy sensitization为题,发表在《自然-通讯》(Nature Communications)上。
该研究分析了临床样本,证实了鼻咽癌具有显著的乏氧特性。进一步,研究通过对细胞表面蛋白数据库收录的上千种蛋白进行筛选发现,TfR1在鼻咽癌中高表达,且与乏氧状态紧密相关,是潜在的乏氧病灶靶点。前期研究证实人重链铁蛋白(HFn)是TfR1的特异性配体,并将其开发为多功能笼状载体,用于递送小分子药物、无机颗粒和核酸等。该研究发现,HFn能够通过特异性结合TfR1,有效靶向鼻咽癌乏氧病灶。
基于这一发现,该研究利用HFn作为载体,装载兼具类过氧化氢酶活性和放射能量吸收特性的铂纳米酶,开发出新型的放疗增敏剂(Pt-HFn)。HFn能够改善铂纳米酶的分散性,并可以通过壳核协同效应增强其类过氧化氢酶活性。在鼻咽癌异种移植模型中,Pt-HFn增敏剂凭借HFn载体的靶向性,有效富集于乏氧病灶,展现出优异的乏氧缓解效果。研究显示,Pt-HFn联合放疗的治疗效果优于临床使用的放射增敏剂甘氨双唑钠,在单剂量和分割放疗模式中均表现出更高疗效,且未观察到明显毒副作用。
上述研究为利用纳米酶克服鼻咽癌乏氧提供了可靠的细胞表面靶点和可行的放疗增敏策略,为临床转化奠定了基础。同时,TfR1作为鼻咽癌乏氧病灶的表面靶点,可为开发新型治疗方法开辟新路径。
研究工作得到国家自然科学基金、国家重点研发计划、中国科学院青年创新促进会会员项目等的支持。
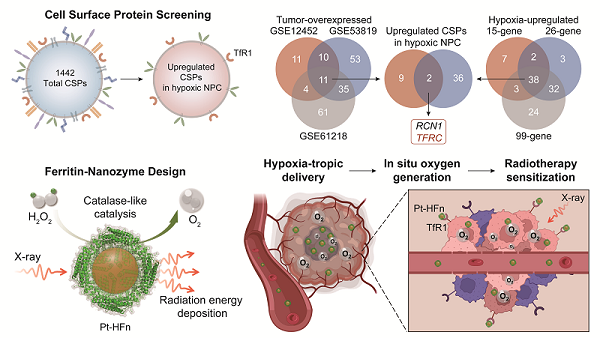
铁蛋白纳米酶靶向TfR1增强鼻咽癌放疗敏感性
供稿人:杨越
审核人:文成锋




