2月17日,《分子细胞》(Molecular Cell)在线发表了中国科学院分子细胞科学卓越创新中心陈玲玲研究组与复旦大学杨力研究组合作完成的关于内源环形RNA降解的最新研究成果。该研究解析了生理条件下环形RNA被核酸内切酶DIS3监控降解的新机制,实现了对环形RNA“生老病死”过程中特异调控及分子特征等基础研究的闭环。
环形RNA由mRNA前体外显子反向剪接而成,具有区别于线性RNA的生成加工、转运代谢和功能发挥途径与调控规律。有研究发现,在应激条件下,双链RNA病毒激活核酸酶RNase L可导致环形RNA大规模降解;而正常条件下,仅有个别含m6A修饰或具特殊结构的环形RNA可被降解。但是,正常条件下环形RNA代谢稳态维持的分子机制尚不清楚。
一般认为,环形RNA的闭环结构使其对核酸外切酶不敏感而依赖核酸内切酶。基于这一推测,该研究对不同核酸内切酶如ANG、DIS3、ERN1、G3BP1、RNASE4、RNAESH2A、SMG6以及辅因子UPF1、UPF2进行敲降筛选,发现敲降核酸内切酶DIS3引起细胞内大部分环形RNA的表达上调。研究使用核酸内切酶失活的DIS3突变体进行回补实验和RNA免疫沉淀测序实验,发现了这些环形RNA的表达上调依赖DIS3的核酸内切酶活性,且DIS3能够直接结合由DIS3敲降引起的表达上调的环形RNA。进一步,研究显示,DIS3介导的环形RNA降解途径在人和小鼠中高度保守。
DIS3具有核酸内切酶活性和3'-5'端的核酸外切酶活性,在细菌到人等多数生物中广泛存在。此前,研究认为,DIS3是核酸外切酶复合体的重要组分,在细胞核内发挥调控RNA加工、成熟与质量监控的作用。而进一步研究发现,DIS3具有不依赖于核酸外切酶复合体,在细胞浆内降解环形RNA的全新途径和机制。该研究通过蔗糖密度梯度离心实验发现,DIS3介导的环形RNA降解途径发生在细胞浆中。同时,免疫荧光共定位显示,仅有10%的DIS3与核酸外切酶复合体组分共定位,提示DIS3具有不依赖于核酸外切酶复合体的功能。进而,研究通过蔗糖密度梯度离心实验、DIS3敲降实验和高通量测序,对筛选出DIS3偏好降解的环形RNA与非DIS3偏好降解的环形RNA进行序列比较分析,鉴定发现具有U-rich motif的环形RNA易被DIS3识别和降解。更重要的是,研究通过建立环形RNA的切割实验,证明体外合成的环形RNA在体外和细胞内均有可控的稳定性,即含有U-rich基序数目不同,可改变环形RNA的稳定性,且该过程依赖DIS3活性。
这一研究揭示了正常细胞状态下DIS3介导的全转录组水平环形RNA降解的新途径,发现了DIS3不依赖于核酸外切酶复合体的新功能,为体外合成稳定性可控的环形RNA奠定了理论基础。
研究工作得到国家自然科学基金委员会、科学技术部、中国科学院等的支持。
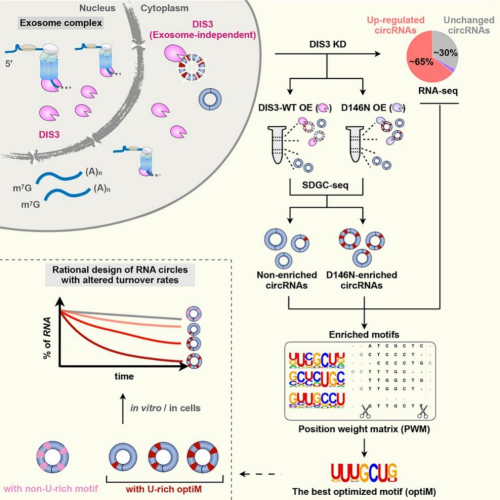
核酸内切酶DIS3降解环形RNA及机制
供稿人:杨越
审核人:文成锋




